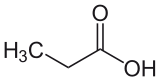
Acide propanoïque
L'acide propanoïque ou acide propionique est un acide carboxylique saturé à 3 atomes de carbone.
| Acide propanoïque | |||
|---|---|---|---|
 |
|||
| Général | |||
| Nom IUPAC | Acide propanoïque | ||
| Synonymes | acide propionique Acide éthylformique |
||
| No CAS | |||
| No EINECS | |||
| No E | E280 | ||
| FEMA | |||
| SMILES |
|
||
| InChI |
|
||
| Apparence | liquide incolore, huileux, d'odeur âcre. [1] | ||
| Propriétés chimiques | |||
| Formule brute | C3H6O2 [Isomères] |
||
| Masse molaire | 74, 0785 g∙mol-1 C 48, 64 %, H 8, 16 %, O 43, 2 %, |
||
| pKa | 4, 87 | ||
| Propriétés physiques | |||
| T° fusion | -21 °C[1] | ||
| T° ébullition | 141 °C[1] | ||
| Solubilité | dans l'eau : particulièrement bonne[1] | ||
| Masse volumique | (eau = 1) : 0.99[1] | ||
| T° d'auto-inflammation | 485 °C[1] | ||
| Point d'éclair | 54 °C (c. f. ) ; 57 °C (c. o. ) [1] | ||
| Limites d'explosivité dans l'air | en volume % dans l'air : 2.1-12[1] | ||
| Pression de vapeur saturante | à 20 °C : 390 Pa[1] | ||
| Viscosité dynamique | 1.10-3 Pa. s | ||
| Propriétés optiques | |||
| Indice de réfraction | 1, 397 | ||
| Précautions | |||
|
|
|||
|
|||
|
|
|||
| Phrases R : 34, | |||
| Phrases S : (1/2), 23, 36, 45, | |||
|
|
|||
|
|||
|
|
|||
|
|
|||
   |
|||
|
|
|||
 Danger |
|||
| Écotoxicologie | |||
| LogP | 0.33[1] | ||
|
|
|||
L'acide propanoïque ou acide propionique (venant du grec "pion" voulant dire "gras") est un acide carboxylique saturé à 3 atomes de carbone.
Historique
Cet acide a été découvert par Johann Gottlieb en 1844 dans les produits de dégradation du sucre. Peu de temps après il a été synthétisé par d'autres voies par des chimistes qui n'ont pas fait tout de suite le lien. C'est le français Jean-Baptiste Dumas qui a mis en relation ces produits baptisant l'acide nouvellement caractérisé acide propionique (du grec protos=premier et pion=gras) en référence à sa particularité qui plus est léger des acides gras, autrement dit capable de donner du savon par saponification.
Cet acide se présente sous la forme d'un liquide incolore, corrosif ainsi qu'à l'odeur désagréable. Il est miscible à l'eau mais peut être relargué par simple ajout de sel. A l'état gazeux il présente un point commun avec ses homologues plus légers à savoir une forte entorse à la loi des gaz parfaits; en effet il reste à l'état de dimère lié par liaison hydrogène en phase gazeuse. Il a les propriétés communes à l'ensemble des acides carboxyliques comme la possibilité de former des amines, esters, anhydride et autres halogénures d'acyles. Il peut aussi subir une halogénation de Hell-Volhard-Zelinsky qui consiste en une α-halogénation par le brome en présence de PBr3.
Production
La production industrielle d'acide propionique se fait par oxydation de propanal. La présence de catalyseur à base de cobalt ou de manganèse rend la réaction rapide même à température ambiante. En pratique on travaille entre 40 et 50 °C. L'équation de la réaction est :
Il y a également une autre filière de production de cet acide comme sous-produit de la synthèse d'acide acétique. Jadis importante, cette filière est devenue mineure dans la production d'acide. Le plus gros producteur d'acide est BASF.
Utilisations
Cet acide est un intermédiaire chimique particulièrement utile. On s'en sert pour modifier les fibres de cellulose synthétique. Il intervient dans la synthèse de médicaments. Enfin des esters de cet acide sont utilisés comme solvant ou comme intermédiaire dans la synthèse de composant de parfum ou d'arôme.
L'acide propionique en biologie
Notes et références de l'article
- ACIDE PROPIONIQUE, fiche de sécurité du Programme Mondial sur la Sécurité des Substances Chimiques, consultée le 9 mai 2009
- ↑ «Acide propionique» dans la base de données de produits chimiques Reptox de la CSST (organisme canadien responsable de la sécurité et de la santé au travail), consulté le 23 avril 2009
- ↑ Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
Voir aussi
Liens et documents externes
Recherche sur Google Images : |
|
"de l'acide propanoïque" L'image ci-contre est extraite du site intellego.fr Il est possible que cette image soit réduite par rapport à l'originale. Elle est peut-être protégée par des droits d'auteur. Voir l'image en taille réelle (508 x 761 - 15 ko - )Refaire la recherche sur Google Images |
Recherche sur Amazone (livres) : |
Voir la liste des contributeurs.
La version présentée ici à été extraite depuis cette source le 11/11/2009.
Ce texte est disponible sous les termes de la licence de documentation libre GNU (GFDL).
La liste des définitions proposées en tête de page est une sélection parmi les résultats obtenus à l'aide de la commande "define:" de Google.
Cette page fait partie du projet Wikibis.




 Accueil
Accueil Recherche
Recherche Début page
Début page Contact
Contact Imprimer
Imprimer Accessibilité
Accessibilité